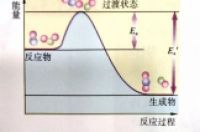
2017年高考化学考试说明中特别增加了一条:了解反应活化能的概念,了解催化剂的重要作用。2018年的与2017年一样,没有改变,2019年也没有变化。
高考题中通过反应历程图考查催化剂是一个什么的演变过程,下面通过一系列的高考题就可以看出一点端倪。
一、题源——教材中的示意图
1、苏教版如图:
反应热为△H =Ea-Ea′。
注意:图中使用催化剂时的活化能为Ea1。示意图中有两个峰。
参考陕西单晓海老师文章
2、人教版、鲁科版
二、高考题考查的演变
1、(2011全国大纲卷,T9)反应A+B→C(△H<0)分两步进行:
①A+B→X(△H>0),②X→C(△H<0)。
下列示意图中,能正确表示总反应过程中能量变化的是
【答案】D
【解析】由反应A+B→C(△H<0)分两步进行①A+B→X(△H>0)②X→C(△H<0)可以看出,A+B→C(△H<0)是放热反应,
A和B的能量之和C,由①A+B→X(△H>0)可知这步反应是吸热反应,X→C(△H<0)是放热反应,故X的能量大于A+B;A+B的能量大于C,X的能量大于C。
2、(2011江苏卷,T4)某反应的反应过程中能量变化如图1所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
B.催化剂能改变该反应的焓变
C.催化剂能降低该反应的活化能
【答案】C
【解析】A项,从图中看,反应物的总能量低于生成物的能量,故为吸热反应,错;B项,焓变是指反应物与生成物之间的能量差值,与反应过程无关,错;C项,加入催化剂之后,E2变小,说明活化能减小了,正确;D项,正、逆反应的活化能大小不变,错。
3、(2014·海南单科化学卷,T8)某反应过程能量变化如图所示,下列说法正确的是
A、反应过程a有催化剂参与
C、改变催化剂,可改变该反应的活化能
D、有催化剂的条件下,反应的活化能等于E1 E2
【答案】BC
【解析】A、由图可知,反应过程a需要的活化能比b要高,所以a没有催化剂参与,A错误;
B、由图可知,该反应中,反应物的总能量大于生成物的总能量,所以该反应属于放热反应,反应的热效应等于反应物与生成物能量之差,即△H,B正确;
C、使用催化剂,改变了反应进行的途径,降低了反应的活化能,C正确。
有催化剂的条件下,反应的活化能等于E1,D错误;
4、(2014·北京卷,T9)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下;下列说法中正确的是
A、CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
【答案】C
【解析】根据能量--反应过程的图像知,状态I的能量高于状态III的能量,故该过程是放热反应,A错误;
根据状态I、II、III可以看出整个过程中CO中的C和O形成的化学键没有断裂,故B错误;由图III可知,生成物是CO2,具有极性共价键,故C正确;
状态Ⅰ →状态Ⅲ表示CO与O反应的过程,故D错误。
5、(2015·海南单科化学卷,T16)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2,其△H=____________kJ·mol¯1。
(3)根据图像可知N2O与NO反应生成氮气和二氧化氮的反应热为(209-348)kJ/mol=-109kJ/mol。
6、(2015·海南单科化学卷,T11)由反应物X转化为Y和Z的能量变化如图所示。下列说法正确的是()
A.由X→Y反应的ΔH=E5−E2
B.由X→Z反应的ΔH<0
C.降低压强有利于提高Y的产率
D.升高温度有利于提高Z的产率
【答案】BC
【解答】解:A.根据化学反应的实质,由X→Y反应的△H=E3﹣E2,故A错误;
B.由图象可知,反应物的总能量高于生成物的总能量,该反应为放热反应,即由反应的△H<0,故B正确;
C.根据化学反应2X(g)=3Y(g),该反应是气体系数和增加的可逆反应,降低压强,平衡正向移动,有利于提高Y的产率,故C正确;
D.由B分析可知,该反应为放热反应,升高温度,平衡逆向移动,Z的产率降低,故D错误.
7、(2018·北京卷,T7)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。下列说法不正确的是
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C―H键发生断裂
C.①→②放出能量并形成了C―C键
D.该催化剂可有效提高反应物的平衡转化率
【答案】D
【解析】A. CH4与CO2在催化剂存在时生成CH3COOH,总反应为CH4 CO2=CH3COOH,只有CH3COOH一种生成物,原子利用率为100%,A正确;
CH4选择性活化变为①的过程中,有1个C-H键断裂,B正确;
C.根据图示,①的总能量高于②的总能量,①→②放出能量; 对比①和②,①→②形成C-C键,C正确;
D.催化剂只影响化学反应速率,不影响化学平衡,不能提高反应物的平衡转化率,D错误。
8、(2018·海南卷,T12)炭黑是雾霾中和重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如右图所示。活化氧可以快速氧化二氧化硫。下列说法正确的是
A.每活化一个氧分子吸收0.29eV的能量
B.水可使氧分子活化反应的活化能降低0.42eV
C.氧分子的活化是O—O的断裂与C—O键的生成过程
D.炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
【答案】CD
解析:由活化过程的能量变化模拟图可知,每活化一个氧分子放出0.29eV的能量,A项错误;
水可使氧分子活化反应的活化能降低包括两部分,类似前面示意图中的两个峰,但是活化能变化是第一个。所以炭黑与氧气生成中间产物使活化能降低0.18eV,
B项错误;结合图示,比较反应物与目标物质的结构可知,C项正确;
根据“活化氧可以快速氧化二氧化硫”可以判定,D项正确。
9、(2019·全国1卷,T28)(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用标注。
可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________eV,写出该步骤的化学方程式_______________________。
(3)由题中图示可知水煤气变换时反应前相对能量0eV,反应后相对能量-0.72eV,反应为放热反应,故△H小于零。该历程中最大的能垒(活化能)应是COOH* H* H2O*=COOH* 2H* OH*反应时由相对能量-0.16eV升至1.86eV 的过渡态2再降至1.41eV。E正=1.86-(-0.16)=2.02(ev)。
题中设问“该历程中最大能垒(活化能)”,需要对活化能加深认知,为能量上升阶段,(爬坡阶段)可知最大的活化能为﹣0.16到1.86阶段。
10、(2020北京新高考测试题5)
选B
11.(2020山东新高考测试)热催化合成氨面临的两难问题是:釆用高温增大反应速率的同时会因平衡限制导致NH3 产率降低。我国科研人员研制了 Ti・H・Fe双温区催化剂(Ti-H区域和Fe区域的温度差可 超过100°C)。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是 ( )
A.①为氮氮三键的断裂过程
B.①②③在高温区发生,④⑤在低温区发生
C.④为N原子由Fe区域向Ti-H区域的传递过程
D.使用Ti-H-Fe双温区催化剂使合成氨反应转变为吸热反应
【答案】BC
【解析】
A选项,经历①过程之后氮气分子被催化剂吸附,并没有变成氮原子,所以A错误。
B选项,①为催化剂吸附N2的过程,②为形成过渡态的过程,③为N2解离为N的过程,以上都需要在高温时进行。④⑤在低温区进行是为了增加平衡产率,所以B正确。
C选项,由题中图示可知,过程④完成了Ti-H-Fe-*N到Ti-H-*N-Fe两种过渡态的转化,N原子由Fe区域向Ti-H区域传递。C正确。
D选项,化学反应不会因加入催化剂而改变吸放热情况,所以D错误。
三、启示
1、反应示意图由简单变复杂。前面只考查反应物生成物相对能量的大小,判断放热吸热反应。通过示意图波峰高低来判断有无催化剂。
2、单峰变双峰。考查我们哪个峰才是催化剂改变的活化能。
3、示意图与物质的分子模型结合,加大信息的干扰作用。
4、示意图由定性判断变成定量计算焓变。
5、示意图变成能垒图,通过相对能量来计算活化能。
我们是不是通过上面一系列演变,可以找到一些备考方向。
但是20届各地高考模拟题在这个上面大做文章。个人观点认为没有必要,高考命题专家的水平我们还是要敬佩的,不会被这些铺天盖地的模拟题所左右。
所以我们在备考时,在这个知识点上不要太纠结,也不要浪费太多精力,把文章上面的例题过一下就可以。




